昨日(3月31日),商务部、海关总署、国家药品监督管理局联合发布了《关于有序开展医疗物资出口的公告》(以下简称《公告》)。
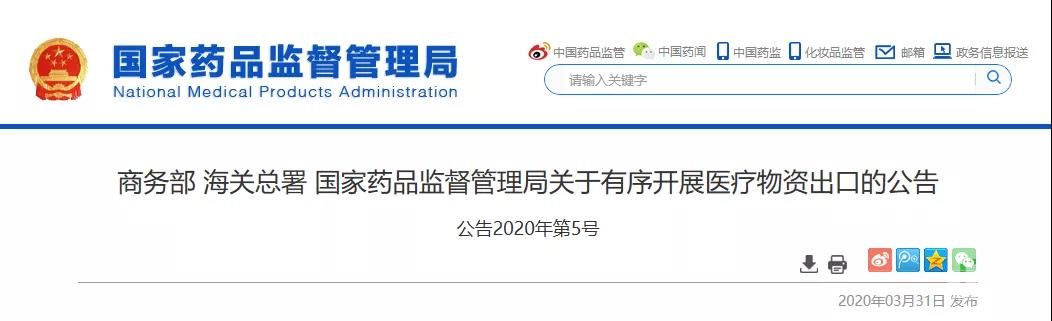
《公告》中明确,自4月1日起,出口新型冠状病毒检测试剂、医用口罩、医用防护服、呼吸机、红外体温计的企业向海关报关时,须提供书面或电子声明(模版见附件1),承诺出口产品已取得我国医疗器械产品注册证书(相关注册信息见附件2),符合进口国(地区)的质量标准要求。
海关凭药品监督管理部门批准的医疗器械产品注册证书验放。上述医疗物资出口质量监管措施将视疫情发展情况动态调整。
出口规则的变动,也就意味着,从今天(4月1日)开始,没有国内注册证的上述防疫相关物资将不予出口!
随着各国疫情的全面爆发,抗疫物质全球紧缺,许多国家开始从中国采购防疫物资。各大企业出口业务的增长的同时,随之带来的一个问题就是对于产品质量的把控。
近期,市面上就出现了由中国出口的新冠病毒检测试剂灵敏度遭到质疑的问题。据西班牙卫生部官方发文称,在中国购买的快速检测试剂盒质量不合格,效果远不如预期。
出口海外检验试剂不合格问题,一时间引发了大量的讨论,讨论中无疑也引起了国家对于出口物资质量监管的重视。
据涉事企业官方回应称,假阴性的出现不排除因验证时的操作流程、病人病历、采样等事项导致结果偏差的可能,具体原因双方仍在沟通核实。
而值得注意的是,这起事件中确实存在企业出口检验试剂仅有欧盟认证,未在国内取得注册证的事实。
事实上,我国对于疫情相关医疗器械的质量要求一直很严格,对于出口的抗疫物资也非常的重视。本次三部委联合出台的出口新规也是出于对出口抗疫物资质量的严格把关,避免再次出现此类争议事件。
对于正在进行出口业务的相关械企而言,目前的首要任务就是申请国内的医疗器械产品注册证书,获得“中国认证”。与此同时,这也是对于医疗器械生产厂家的一个提醒,特殊时期下更要做好产品质量的把关。
此外,需要提醒的是,出口规则的调整后,国内注册证的审核标准将更加严格,审核时间或将变长,械企要及时做好销售调整。
目前具备出口资质的产品 :新型冠状病毒检测试剂23个;医用防护口罩150个、医用外科口罩523个、一次性使用医用口罩752个;医用防护服301个;呼吸机62个;红外体温计236。
文章来源:医疗器械经销商联盟
